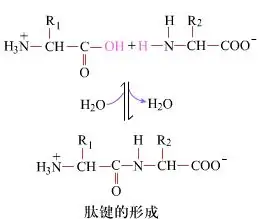
A felszínen a peptidkötések kialakulása, amely dipeptideket eredményez, egyszerű kémiai folyamat.Ez azt jelenti, hogy a két aminosav komponens peptidkötéssel, amidkötéssel kapcsolódik össze, miközben dehidratálódik.
A peptidkötés kialakulása egy aminosav aktiválása enyhe reakciókörülmények között.(A) karboxilcsoport, második aminosav (B) A nukleofil aktivált karboxilrész ezután dipeptidet (AB) alkot."Ha az (A) karboxil komponens nincs védve, a peptidkötés kialakulása nem szabályozható."Melléktermékek, például lineáris és ciklikus peptidek keverhetők az AB célvegyületekkel.Ezért minden funkciós csoportot, amely nem vesz részt a peptidkötés kialakításában, átmenetileg reverzibilis módon védeni kell a peptidszintézis során.
Tehát a peptidszintézis – az egyes peptidkötések kialakulása – az aggregáció három lépéséből áll.
Az első lépés néhány védelemre szoruló aminosav előállítása, és az aminosavak ikerionos szerkezete már nem létezik.
A második lépés egy kétlépéses reakció a peptidkötések kialakítására, amelyben először az N-védett aminosav karboxilcsoportja aktiválódik az aktív intermedierré, majd jön létre a peptidkötés.Ez a kapcsolt reakció történhet egylépéses reakcióként vagy két egymást követő reakcióként.
A harmadik lépés a védőalap szelektív eltávolítása vagy teljes eltávolítása.Bár minden eltávolítás csak az összes peptidlánc összeállítása után történhet meg, a védőcsoportok szelektív eltávolítása is szükséges a peptidszintézis folytatásához.
Mivel 10 aminosav (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec és Cys) tartalmaz oldallánc funkciós csoportokat, amelyek szelektív védelmet igényelnek, megnehezítve a peptidszintézist.A szelektivitás eltérő követelményei miatt meg kell különböztetni az ideiglenes és a félig állandó védelmi bázisokat.A következő lépésben ideiglenes védőcsoportokat használunk az aminosav vagy karboxil funkciós csoportok ideiglenes védelmének tükrözésére.A félig állandó védőcsoportokat a már kialakult peptidkötések vagy aminosav-oldalláncok zavarása nélkül távolítják el, néha a szintézis során.
"Ideális esetben a karboxilkomponens aktiválása és az azt követő peptidkötések kialakulása (kapcsolási reakciók) gyors legyen, racém vagy melléktermékképződés nélkül, és moláris reagenseket kell alkalmazni a magas hozam elérése érdekében."Sajnos egyik kémiai kapcsolási módszer sem elégíti ki ezeket a követelményeket, és kevés alkalmas gyakorlati szintézisre.
A peptidszintézis során a különféle reakciókban részt vevő funkciós csoportok általában a manuális központhoz kapcsolódnak, ez alól a glicin az egyetlen kivétel, és fennáll a rotáció veszélye.
A peptid szintézis ciklusának utolsó lépése az összes védőcsoport eltávolítása.A védőcsoportok szelektív eltávolítása fontos a peptidlánc meghosszabbítása szempontjából, amellett, hogy a védelem teljes eltávolítása szükséges a dipeptid szintézisben.A szintetikus stratégiákat gondosan meg kell tervezni.A stratégiai választástól függően az N szelektíven eltávolíthatja az α-amino- vagy karboxil-védőcsoportokat.A „stratégia” kifejezés az egyes aminosavak kondenzációs reakcióinak sorozatára utal.Általánosságban elmondható, hogy különbség van a fokozatos szintézis és a fragmentumkondenzáció között.A peptidszintézis (más néven „hagyományos szintézis”) oldatban megy végbe.A legtöbb esetben a peptidlánc fokozatos meghosszabbítása csak úgy szintetizálható, ha a peptidláncot rövidebb fragmentumok szintetizálására használjuk.Hosszabb peptidek szintéziséhez a célmolekulákat megfelelő fragmensekre kell szegmentálni, és meg kell határozni, hogy minimálisra tudják csökkenteni a C-terminális differenciálódás mértékét.Az egyes töredékek fokozatos összeállítása után a célvegyületet egyesítjük.A peptidszintézis stratégiája magában foglalja a legjobb és legmegfelelőbb védőfragmens kiválasztását, a peptidszintézis stratégiája pedig a védőbázisok legmegfelelőbb kombinációjának és a fragmentumkonjugáció legjobb módszerének kiválasztását foglalja magában.
Feladás időpontja: 2023. július 19